慢性肾脏疾病(chronic kidney disease, CKD)是指患者出现肾脏损害,或者出现肾小球滤过率下降<60mL/min以上,持续时间超过3个月以上的临床综合征。目前,全球约有10%至13%的人患有CKD。日益增加的流行率和高昂的治疗费用使CKD成为一个主要的国际公共卫生问题,给患者、家庭和社会带来巨大的负担。肾脏纤维化(renal fibrosis)是各种CKD的共同病理特征和最终表现。尽管已有多项研究揭示了参与肾脏纤维化进展的细胞信号通路,但迄今为止临床上尚无有效安全的治疗肾脏纤维化和CKD的方法。
孕烷X受体(pregnane X receptor,PXR)是核受体超家族的一员,是配体激活的转录因子,在内源性和外源性药物代谢中起重要作用[1]。已有研究证实小鼠PXR特异性激动剂孕烯醇酮-16α-碳腈(pregnenolone-16α-carbonitrile,PCN)激活肾脏PXR对急性肾损伤(AKI)具有保护作用[2, 3]。然而,PXR在CKD和肾脏纤维化中的作用尚不清楚。
近日,华东师范大学张晓燕教授与大连医科大学管又飞教授合作,在《Acta Pharmacologica Sinica(中国药理学报)》上发表题为“Pregnane X receptor activation alleviates renal fibrosis in mice via interacting with p53 and inhibiting the Wnt7a/β-catenin signaling”的研究论文,该研究首次阐明了PXR与肾脏纤维化的关系,发现PXR激活能有效缓解肾脏纤维化。该研究在野生型小鼠和人源化PXR转基因小鼠使用0.2%腺嘌呤饮食构建CKD模型。研究发现使用小鼠PXR激动剂PCN和人PXR激动剂利福平(rifampicin,RIF)分别处理野生型和人源化PXR转基因CKD小鼠都可显著改善腺嘌呤诱导的小鼠肾功能下降和肾脏纤维化;此外,PCN还能明显减轻单侧输尿管梗阻(unilateral ureter obstruction,UUO)诱导的小鼠肾脏纤维化。与此相反,PXR基因全身缺失则显著加重了腺嘌呤饮食诱导和UUO相关CKD模型小鼠的肾功能下降和肾脏纤维化。
大量的研究表明,TGFb/Smad3和Wnt/β-catenin信号通路持续异常激活可加速肾脏纤维化的进展,而抑制上述通路则可有效缓解肾脏纤维化[4-6]。该团队发现PXR激活在体内和体外都能显著抑制Smad3信号通路和Wnt7a/β-catenin信号通路。免疫荧光和Co-IP实验证实PXR在肾小管上皮细胞的细胞核中与p53共定位并存在相互作用。p53作为一种重要的肿瘤抑制因子,近年来被发现与其它信号通路协同促进肾脏纤维化。目前已知,Wnt/β-catenin信号通路是p53的主要靶点,p53和Wnt信号通路之间存在分子间的相互作用和相互转激活[7-10]。该研究用ChIP和双荧光素酶报告基因实验进一步证明p53可以与Wnt7a基因的启动子结合并上调其转录,而PXR则能有效地抑制p53的上述作用。此外,p53过表达能通过增加Wnt7a基因表达,继而诱导β-catenin及其下游基因纤维连接蛋白(fibronectin)的表达。先前的研究表明TGFβ1可刺激p53-Smad3蛋白复合物的组装,这是肾脏纤维化相关基因转录所必需的[11, 12]。以上结果提示PXR可能通过抑制p53对TGFβ1/Smad3和Wnt7a/β-catenin两个信号通路的活化进而缓解肾脏纤维化,该发现为研发针对PXR为靶点的临床治疗药物提供了理论基础和实验依据。
大连医科大学博士生明文华为第一作者,华东师范大学张晓燕教授和大连医科大学管又飞教授为共同通讯作者。
本项目得到了国家重点研发计划、国家自然科学基金和华东师范大学医药卫生联合基金等项目支持。
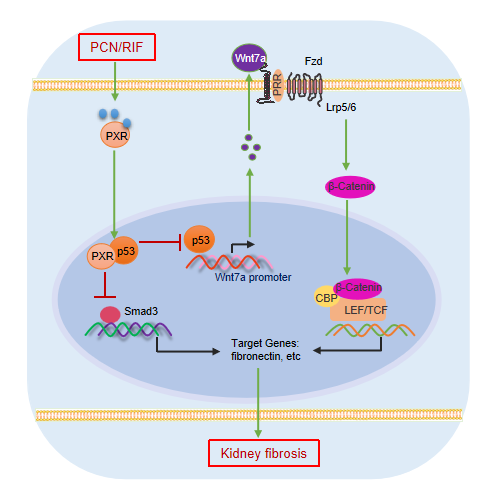
PXR通过与p53相互作用减轻肾脏纤维化的机制
参考文献
1 Luan ZL, Zhang C, Ming WH, Huang YZ, Guan YF, Zhang XY. Nuclear receptors in renal health and disease. EBioMedicine 2022; 76: 103855.
2 Luan Z, Wei Y, Huo X, Sun X, Zhang C, Ming W, et al. Pregnane X receptor (PXR) protects against cisplatin-induced acute kidney injury in mice. Biochim Biophys Acta Mol Basis Dis 2021; 1867: 165996.
3 Yu X, Xu M, Meng X, Li S, Liu Q, Bai M, et al. Nuclear receptor PXR targets AKR1B7 to protect mitochondrial metabolism and renal function in AKI. Sci Transl Med 2020; 12.
4 Zuo Y, Liu Y. New insights into the role and mechanism of Wnt/beta-catenin signalling in kidney fibrosis. Nephrology (Carlton) 2018; 23 Suppl 4: 38-43.
5 Feng Y, Ren J, Gui Y, Wei W, Shu B, Lu Q, et al. Wnt/beta-Catenin-Promoted Macrophage Alternative Activation Contributes to Kidney Fibrosis. J Am Soc Nephrol 2018; 29: 182-93.
6 Surendran K, Schiavi S, Hruska KA. Wnt-dependent beta-catenin signaling is activated after unilateral ureteral obstruction, and recombinant secreted frizzled-related protein 4 alters the progression of renal fibrosis. J Am Soc Nephrol 2005; 16: 2373-84.
7 Xiao Q, Werner J, Venkatachalam N, Boonekamp KE, Ebert MP, Zhan T. Cross-Talk between p53 and Wnt Signaling in Cancer. Biomolecules 2022; 12.
8 Lee KH, Li M, Michalowski AM, Zhang X, Liao H, Chen L, et al. A genomewide study identifies the Wnt signaling pathway as a major target of p53 in murine embryonic stem cells. Proc Natl Acad Sci U S A 2010; 107: 69-74.
9 Han D, Xu Y, Peng WP, Feng F, Wang Z, Gu C, et al. Citrus Alkaline Extracts Inhibit Senescence of A549 Cells to Alleviate Pulmonary Fibrosis via the beta-Catenin/P53 Pathway. Med Sci Monit 2021; 27: e928547.
10 Gu Z, Tan W, Feng G, Meng Y, Shen B, Liu H, et al. Wnt/beta-catenin signaling mediates the senescence of bone marrow-mesenchymal stem cells from systemic lupus erythematosus patients through the p53/p21 pathway. Mol Cell Biochem 2014; 387: 27-37.
11 Higgins SP, Tang Y, Higgins CE, Mian B, Zhang W, Czekay RP, et al. TGF-beta1/p53 signaling in renal fibrogenesis. Cell Signal 2018; 43: 1-10.
12 Overstreet JM, Samarakoon R, Meldrum KK, Higgins PJ. Redox control of p53 in the transcriptional regulation of TGF-beta1 target genes through SMAD cooperativity. Cell Signal 2014; 26: 1427-36.
